
Máy đo huyết áp bắp tay ADAPTER BEURER BM40
Giá: 1.020.000 VNĐ
Chi tiết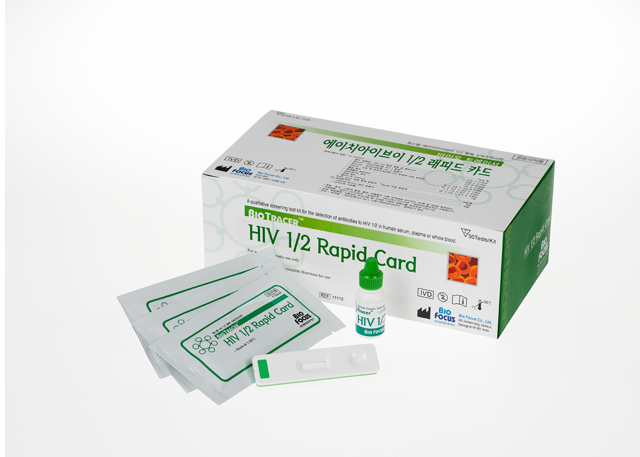
Tên: BioTracer HIV 1/2 (Cassette): Xét nghiệm nhanh chẩn đoán HIV
Mã:
Giá: Theo danh mục
Giảm giá:
Tình trạng: Còn hàng
Đặt hàng
Trạng thái: Còn hàng
Hướng dẫn sử dụng que thử chẩn đoán BioTracerTM HIV 1/2 Rapid Card
BioTracerTM HIV 1/2 Rapid Card được dùng để định tính các kháng thể kháng virus gây suy giảm miễn dịch ở người (HIV) tuýp 1, 2 và O trong huyết thanh, huyết tương hoặc máu toàn phần người.
GIẢI THÍCH THỬ NGHIỆM CHẨN ĐOÁN
Virus gây suy giảm miễn dịch ở người (HIV) là một tác nhân gây ra bệnh suy giảm miễn dịch có tên gọi AIDS. Việc định tính phát hiện các kháng thể kháng HIV tuýp 1 và 2 rất có ý nghĩa để chẩn đoán sự nhiễm virus HIV hay chưa. Các protein tái tổ hợp đặc hiệu với HIV (p24 và gp41 đối với HIV1, và gp36 đối với HIV2) được sử dụng có khả năng phát hiện kháng thể kháng HIV tuýp 1 và 2 trong huyết thanh, huyết tương hoặc máu toàn phần người với độ chính xác cao.
NGUYÊN TẮC CỦA THỬ NGHIỆM
BioTracerTM HIV 1/2 Rapid Card dựa trên nguyên tắc thử nghiệm sắc ký miễn dịch in vitro để xác định định tính kháng thể kháng HIV tuýp 1 và 2 trong huyết thanh, huyết tương hoặc máu toàn phần người. Khi thêm mẫu thử và mẫu pha loãng vào “sample pad”, mẫu sẽ di chuyển đến “conjugate pad” và tái hỗn dịch với phức hợp kháng nguyên HIV tuýp 1 và 2 – vàng cộng hợp đã làm khô trên “conjugate pad”. Hỗn hợp sẽ di chuyển dọc theo màng bằng hiện tượng mao dẫn và phản ứng với kháng nguyên HIV tuýp 1 và 2 đã giữ cố định trên vùng phản ứng (ký hiệu T). Nếu kháng thể kháng HIV có mặt đủ trong mẫu thử, vạch màu trong vùng T sẽ xuất hiện. Nếu không có hoặc kháng thể kháng HIV không đủ trong mẫu thử thì vùng T sẽ vẫn không màu. Mẫu thử tiếp tục di chuyển đến vùng chứng (ký hiệu C) và tạo thành vạch có màu đỏ hoặc tím, cho thấy thử nghiệm đã được tiến hành đúng, thích hợp và kết quả là có giá trị.
BỘ THỬ NGHIỆM BAO GỒM
1. Các que thử
2. Hướng dẫn sử dụng
3. Dung môi hồi chỉnh (chai 5 ml) chứa đệm Tris-HCl 100 mM.
LẤY MẪU VÀ CHUẨN BỊ
1. Đối với máu toàn phần:
• Lấy máu toàn phần theo quy trình thường quy của phòng thí nghiệm lâm sàng.
• Các mẫu máu toàn phần phải được tíến hành thử nghiệm ngay sau khi có mẫu. Trong trường hợp bảo quản ở 2 – 8 0C, mẫu máu có thể dùng trong vòng 24 giờ.
2. Đối với mẫu huyết thanh hay huyết tương
• Thử nghiệm phải được tiến hành ngay sau khi thu được mẫu xét nghiệm. Không được để mẫu ở nhiệt độ phòng trong thời gian dài.
• Nếu bảo quản mẫu ở 2-8 0C thì mẫu có thể giữ được trong 2 tuần. Nếu muốn giữ mẫu lâu hơn thì phải bảo quản ở -20 0C.
Lưu ý: Mẫu thử nếu có tủa có thể gây ra sự không đồng nhất trong các kết quả thử nghiệm. Do đó mẫu phải được lọc trước khi định tính.
QUY TRÌNH THỬ NGHIỆM
Các mẫu xét nghiệm và bộ kit thử còn nguyên vẹn phải được để ổn định ở nhiệt độ phòng trước khi tiến hành thử nghiệm.
Lấy các que thử ra khỏi bao, đặt lên bề mặt phẳng và sạch.
Dùng pipet hút 10 µl huyết thanh (hoặc huyết tương) hoặc 20 µl máu toàn phần cho vào giếng thử (vùng ký hiệu S). Sau đó thêm 4 giọt (100 µl) dung môi hồi chỉnh vào giếng thử.
Đọc kết quả thử nghiệm sau 5 – 20 phút. Không diễn giải kết quả sau 20 phút nữa.
Lưu ý: Tiến hành thử nghiệm ngay khi lấy que thử ra khỏi bao.
DIỂN GIẢI KẾT QUẢ THỬ NGHIỆM
1. Vạch xuất hiện ở vùng C trong cửa sổ kết quả cho biết thử nghiệm đã tiến hành đúng.
2. Vạch ở vùng T cho biết kết quả của thử nghiệm.
ÂM TÍNH: Nếu chỉ có 1 vạch xuất hiện ở vùng C.
DƯƠNG TÍNH: Nếu xuất hiện vạch ở cả vùng C và vùng T (1 và hoặc 2) chứng tỏ thử nghiệm dương tính.
HIV 1 (+) HIV 2 (+) HIV 1 và 2 (+)
KHÔNG CÓ GIÁ TRỊ CHẨN ĐOÁN:
Vùng C không xuất hiện vạch nào trong cửa sổ kết quả sau khi tiến hành thử nghiệm, thử nghiệm được xem như không có giá trị. Nguyên nhân có thể do các bước tiến hành không đúng hoặc que thử đã bị hư. Khuyến cáo thử nghiệm lại mẫu trên 1 que thử mới.
HOẠT ĐỘNG TIẾP THEO
Cũng như các thử nghiệm chẩn đoán khác, một kết luận chẩn đoán lâm sàng không thể chỉ dựa trên 1 kết quả thử nghiệm, mà cần dựa trên nhiều yếu tố khác đánh giá về mặt lâm sàng kết hợp với kết quả xét nghiệm bởi các bác sĩ.
GIỚI HẠN
Kết quả âm tính không loại trừ khả năng vẫn nhiễm HIV. Nếu có nghi ngờ kết quả xét nghiệm, nên tiến hành thử lại trên các thử nghiệm lâm sàng có sẵn khác.
GIỚI HẠN PHÁT HIỆN
Giới hạn phát hiện của BioTracerTM HIV 1/2 Rapid Card là 1 ng/ml.
ĐỘ CHÍNH XÁC
Một nghiên cứu được tiến hành trên 1500 mẫu huyết thanh bao gồm dương tính lẫn âm tính. Mỗi mẫu xét nghiệm được định tính bằng BioTracerTM HIV 1/2 Rapid Card và một thử nghiệm HIV khác có sẵn trên thị trường (phương pháp ELISA) với các hướng dẫn sử dụng tương ứng:
|
BioTracerTM HIV 1/2 Rapid Card
|
||||
|
Dương tính
|
Âm tính
|
Tổng cộng
|
||
|
ELISA
|
Dương tính
|
499
|
1
|
500
|
|
Âm tính
|
1
|
999
|
1000
|
|
|
Tổng cộng
|
500
|
1000
|
1500
|
|
Kết luận: BioTracerTM HIV 1/2 Rapid Card đã được chứng minh cho cùng kết quả độ nhạy > 99,8% (499/500) và độ đặc hiệu là 99,9% (999/1000) trong việc phát hiện kháng thể HIV1/HIV2 so với thử nghiệm ELISA.
LƯU Ý KHI DÙNG
Để xa tầm tay trẻ em. Đọc kỹ hướng dẫn sử dụng trước khi dùng.
1. Chỉ có giá trị chẩn đoán in vitro chuyên biệt.
2. Không ăn uống hoặc hút thuốc trong quá trình thử nghiệm trên mẫu.
3. Đeo găng tay khi làm việc với các mẫu xét nghiệm. Rửa sạch tay sau khi xong việc.
4. Không dùng kit chẩn đoán nếu thấy bao gói bị rách hoặc không còn nguyên vẹn.
5. Nếu mẫu bị tràn, lau thật sạch bằng chất tẩy rửa thích hợp.
6. Khử trùng và xếp tất cả các mẫu xét nghiệm, các bộ kit phản ứng và các vật liệu bị nhiễm khác vào thùng và loại bỏ, xử lý theo phân loại nguy cơ sinh học tiềm tàng.
7. Không tái sử dụng bộ kit.
BẢO QUẢN VÀ HẠN DÙNG
BioTracerTM HIV 1/2 Rapid Card có thể giữ ở 1 – 30 0C. Hạn dùng 18 tháng kể từ ngày sản xuất, không dùng khi đã quá hạn.
Que thử nhạy cảm với ẩm và nhiệt.
Tiêu chuẩn: Cơ sở
Nhà sản xuất:
BIO FOCUS Co., Ltd.,
9F., Daehyun Technoworld, Ojeon-dong, Uiwang-si, Gyeonggi-do, 437-753 Korea.
Ý KIẾN BẠN ĐỌC
Sản phẩm : BioTracer HIV 1/2 (Cassette): Xét nghiệm nhanh chẩn đoán HIV

Giá: 1.020.000 VNĐ
Chi tiết
Giá: 234.000 VNĐ
Chi tiết
Giá: Thỏa thuận
Chi tiết
Giá: 490.000 VNĐ
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: 700.000 VNĐ
Chi tiết
Giá: 580.000 VNĐ
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: 1.500.000 VNĐ
Chi tiết
Giá: Danh mục
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: 28.000
Chi tiết
Giá: 200.000 VNĐ/ Cái
Chi tiết
Giá: 762.000 VNĐ
Chi tiết
Giá: 350.000 VNĐ
Chi tiết
Giá: Thoả thuận
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: 300.000 VNĐ/ Máy
Chi tiết
Giá: 11.000.000 VNĐ
Chi tiết
Giá: Thỏa thuận
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: 1.375.000 VNĐ/ Máy
Chi tiết
Giá: 400.000 VNĐ
Chi tiết
Giá: Theo danh mục
Chi tiết
Giá: Thỏa thuận
Chi tiết